Verde [1], A. Ortúñez [2], S. Villanueva [1], M. Pardo [1]
1. Facultad Veterinaria Zaragoza, Patología Animal. Servicio Diagnóstico Inmunopatología Clínica Animales Compañía. mverde@unizar.es
2. Centro Veterinario Vilazoo, Santa Margalida, Mallorca
Imágenes cedidas por los autores
La leishmaniosis felina (LFel), resultado de la infección natural de los gatos por el parásito Leishmania infantum, fue diagnosticada por primera vez en el mundo en Argelia en 1912 (Sergent et al., 1912). Sin embargo, mientras se han registrado numerosos pacientes enfermos de leishmaniosis canina (Lcan) a lo largo de estos cien años, el número de casos descritos en gatos ha sido muchísimo menor.
En España, la primera descripción clínica de una LFel se realizó en 1933. En toda Europa, desde 1989 hasta 2014 se han descrito solo 59 casos.
Aspectos epidemiológicos
Las tasas de seropositividad estimadas en nuestro país son muy variables (desde 1,7 al 60 %) (Sainz A, 2011), ya que dependen de factores como:
Pero, en general, los valores de seropositividad para LFel son inferiores a los de Lcan para una misma zona geográfica endémica.
Los gatos que viven en zonas endémicas están habitualmente expuestos a ser infectados por el parásito, pero la mayoría de mascotas felinas viven en el interior, por lo que el riesgo de exposición disminuye considerablemente.
En España, como en el resto de Europa, L. infantum es hasta la fecha la única especie de Leishmania aislada en gatos. No existe ninguna diferencia genética o fenotípica entre las cepas aisladas en perros y las aisladas en la especie felina, siendo el zimodema MON-1 el más frecuente (Pennisi y Solano, 2013a).
La LFel es una enfermedad transmitida a los gatos en toda Europa por Phlebotomus spp. Es decir, el mismo vector que transmite la LCan y la leishmaniosis humana (LHum). A su vez, ya ha quedado demostrado por xenodiagnóstico que los Phlebotomus se infectan por L. infantum después de alimentarse de sangre de gatos naturalmente infectados (Maroli et al., 2007). Queda todavía por aclarar el papel que puedan desempeñar los gatos (reservorio alternativo al perro versus hospedador accidental) en la epidemiología de la leishmaniosis en las zonas endémicas.
De todos los estudios sobre seroprevalencia de LFel realizados en los últimos diez años en España (tabla 1), el más reciente se desarrolló en Madrid analizando mediante técnica IFI 346 gatos callejeros (Miró et al., 2014). Los resultados aportan una seroprevalencia de 3,2 % (11/346). Pero no se pudo encontrar ningún gato positivo mediante la técnica PCR en ninguna de las muestras de sangre. Por otra parte, de los 11 gatos IFI seropositivos, tres también eran positivos a FIV, seis a Toxoplasma gondii y ninguno a FeLV. Por lo que parece que los gatos infectados por Toxoplasma, y en menor medida los FIV seropositivos, tienen mayor probabilidad de infectarse por L infantum.
 |
A pesar de que algunas publicaciones recientes (Pennisi et al., 2013b) afirman que las investigaciones epidemiológicas indicarían que la infección felina por L. infantum podría estar siendo subestimada en las zonas endémicas, ni se han descrito ni conocemos ningún caso clínico en nuestra área geográfica (valle medio del Ebro), que es endémica y que, sin embargo, en la especie canina presenta una prevalencia variable, oscilando entre el 2,6 % y el 20 % (Peris et al., 2011).
Desde que en 2007 Maroli demostrase que los Phlebotomus podían ser vectores competentes para la transmisión de la infección en el gato al ingerir sangre de animales infectados ha aumentado la preocupación por determinar si los gatos con los que convivimos pueden o no albergar al parásito y lo que esto puede significar de cara a la Salud Pública. En zonas endémicas puede haber gatos infectados, pero solo una parte muy pequeña de estos animales desarrolla la enfermedad. Es muy probable que el sistema inmunitario del gato sea capaz de controlar la infección de este parásito, ya sea eliminándolo o bien manteniéndolo en un estado crónico subclínico. Solo en una minoría de gatos, probablemente con sistema inmunitario comprometido, progresa la enfermedad y aparecen los signos clínicos.
No existen estudios sobre la patogenia de la LFel, ni sobre la respuesta inmune en la infección por L. infantum en gatos. Se sabe que los títulos de anticuerpos suben a las dos semanas de inoculación experimental (IV o SC) del parásito, pero no aparecen signos clínicos en las infecciones experimentales ni se detectan anomalías biopatológicas claras como sucede en la especie canina (Pennisi et al., 2013a).
Aspectos clínicos
LFel se debe incluir en los listados de diagnósticos diferenciales de diversos procesos que cursan con signos clínicos semejante a los patrones clínicos que a continuación se describen.
La forma cutánea de la LFel
Es la más frecuente y debe tenerse en cuenta en el diagnóstico diferencial de las dermatitis nodulares, de las erosivas-ulcerativas y de las alopécicas. Clínicamente se pueden observar lesiones cutáneas y mucocutáneas.
Una de las presentaciones cutáneas más frecuentes es la dermatitis nodular, caracterizada por nódulos dérmicos subcutáneos indoloros y de localización predominantemente en la cabeza (trufa, belfos, orejas, párpados) (figura 1), y en las patas anteriores y posteriores (cojinetes); pero pueden aparecer en cualquier parte del cuerpo (Navarro et al., 2010).
 |
| Figura 1. Nódulos dérmicos subcutáneos por L. infantum. |
La dermatitis erosiva-ulcerativa se caracteriza por lesiones ulcerativas-costrosas localizadas en cabeza, cara y cuello (orejas, trufa, mandíbula inferior y párpados), en almohadillas plantares (figura 2) o con distribución simétrica bilateral en carpos, codos, tarsos o tuberosidad isquiática.
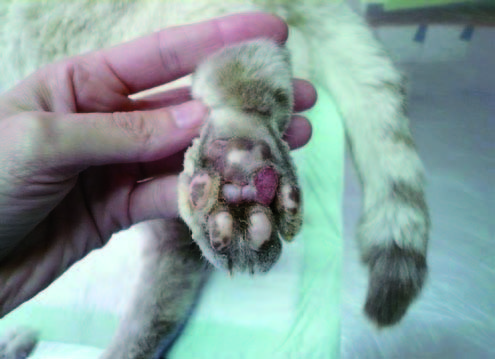 |
| Figura 2. Lesiones erosivas-ulcerativas en almohadillas plantares de un gato infectado por L. infantum. |
También se han descrito lesiones nodulares-ulcerativas en las membranas mucosas; lesiones mucocutáneas en los belfos, lengua (figura 3) parpados y fosas nasales; y vesículas y nódulos hemorrágicos localizados en cabeza (borde de la trufa y borde de las orejas).
 |
| Figura 3. Nódulos mucocutáneos en la lengua de un gato infectado por L. infantum. |
Otros cuadros cutáneos, muy poco frecuentes, incluyen las formas alopécicas, dermatitis escamosa, dermatitis miliar y dermatitis papular. El prurito de diversa intensidad es un signo poco frecuente que solo aparece en menos de un tercio de los casos con sintomatología cutánea.
Formas oculares
Las formas oculares son también muy frecuentes, habiéndose descrito desde blefaritis granulomatosa, conjuntivitis y queratitis, hasta uveítis monolateral (que es la lesión ocular más frecuente) y puede evolucionar a panoftalmitis.
Formas sistémicas generalizadas
La diseminación generalizada del parásito, dando lugar a un cuadro sistémico visceral, es una presentación clínica de escasa presentación en los gatos. Pero en aquellos casos clínicos afectados puede implicar lesiones en el bazo, hígado, riñones y linfonodos. Se puede observar linfadenopatía regional o generalizada, que aparece en un porcentaje elevado de casos. Entre los signos sistémicos más frecuentes se señalan astenia y anorexia.
|
Diagnóstico integral
|
|
Para establecer el diagnóstico en un gato sospechoso, este se debe llevar a cabo de forma integral, incluyendo numerosas pruebas.
Es importante considerar que la utilización de la serología como una prueba de confirmación de la infección podría subestimar el diagnóstico de leishmaniosis. Por otra parte, no debemos olvidar que es altamente probable que exista una enfermedad subyacente o concurrente (FIV, FeLV, alergias, procesos autoinmunes, toxoplasmosis, neoplasias, enfermedades metabólicas); por tanto se deberán realizar pruebas básicas de laboratorio, incluyendo hemograma, bioquímica, urianálisis y proteinograma del suero. |
Diagnóstico
Alteraciones biopatológicas
Pueden presentarse alteraciones biopatológicas como anemia normocitica, normocrómica de moderada a grave; monocitosis, neutrofilia, linfopenia o pancitopenia; urea y creatinina elevadas; fósforo elevado; y proteinograma alterado con hiperglobulinemias.
No obstante, algunas de las alteraciones biopatológicas como la pancitopenia pueden corresponder a anormalidades dependientes de otras patologías concurrentes (FIV, FeLV) o, en general, a un estado de compromiso inmunológico.
Citología
Se realiza para confirmación directa de la presencia de amastigotes en muestras de piel, linfonodos, médula ósea o de cualquier otro tejido afectado (como los nódulos conjuntivales y en el humor acuoso).
Técnicas serológicas
IFI, ELISA, DAT, WB, HAI. De todas ellas ELISA es la más sensible (Penissi et al., 2013).
Examen histopatológico
Biopsia con tinción hematoxilina-eosina (H&E) y técnica de inmunohistoquímica. En la histología convencional de las lesiones cutáneas podemos encontrar dermatitis de nodular a difusa, histiocitica con microorganismos intracitoplasmáticos, o bien un patrón granulomatoso difuso superficial y profundo, con afección de anejos en algunos casos. También se han descrito patrones de dermatitis de la interfaz liquenoide asociada a hiperplasia epidérmica, espongiosis multifocal e hiperqueratosis ortoqueratósica.
En general, en la epidermis aparecen distintos niveles de hiperqueratosis e hiperplasia con focos ulcerados. Para visualizar la presencia de amastigotes en el interior de los macrófagos muchas veces será preciso realizar tinción inmunhistoquímica específica frente a L. infantum.
Técnicas moleculares
Se pueden realizar PCR cualitativo o PCR cuantitativo. Igual que sucede en la especie canina, la PCR realizada en muestras de nódulo linfático es más sensible que en sangre.
Tratamiento y prevención
No hay estudios, en la especie felina, ni sobre cuál es el tratamiento de elección, ni de la vida media, ni de la farmacocinética de los fármacos alopurinol y n-metil-meglumine. Tampoco se tienen datos con evidencia científica suficiente sobre cuál pueda ser el mejor protocolo terapéutico en la LFel.
De lo publicado, podría inferirse que los mejores resultados se obtienen administrando alopurinol a dosis de 10 mg/kg/ 12 h o 20 mg/kg/24 h, hasta la curación clínica. En algunos casos n-metil-meglumina a dosis de 5 mg/kg/24 h o 25 mg/gato/24 h, durante un mes. No se recomienda la combinación de alopurinol con n-metil-meglumine por problemas de toxicidad. No hay datos sobre el uso de miltefosina en gatos.
El pronóstico es reservado y se debe controlar cualquier proceso o situación subyacente que pueda estar comprometiendo el sistema inmune.
No se dispone de otras medidas preventivas que no sean evitar la exposición a los vectores, ya que los repelentes a base de permetrinas son tóxicos para los gatos. Tampoco existe experiencia para el uso de inmunomoduladores o vacunas en la especie felina.
|
Conclusiones
|
|
Bibliografía
- Chatzis MK et al. Vet Parasitol. 2014; 202(3-4):217.
- Maroli M et al. Vet Parasitol.2007; 145:357.
- Miró G et al. Parasit Vectors.2014; 24(7): 112.
- Navarro JAm et al. J Comp Path.2010; 143:297.
- Ortuñez A et al. SEVC. Poster. 2010.
- Pennisi MG et al. J Fel Med Sug. 2013(b); 15(7):638.
- Pennisi MG y Solano L. Ed. Servet.2013(a); pp 185.
- Sainz A. Proceedings. FC- AVEPA.2011; pp.
- Sergent ED et al. Bulletin de la Societé de Pathologie Exotique. 1912; 5:93.
- Peris A. Estudio seroepidemiológico de la dinámica de infección de Leishmania infantum en poblaciones caninas del valle medio del Ebro. Tesis Doctoral Univ. Zaragoza, 2011.